南湖新闻网讯(通讯员 漆良波)9月8日,我校作物遗传改良国家重点实验室、生命科学技术学院蛋白质科学研究团队与清华大学闫创业研究员合作,在中科院主管的Cell Research杂志在线发表题为“Cryo-EM structure of the human mitochondrial translocase TIM22 complex”(《人线粒体转位酶TIM22复合物的冷冻电镜结构》)的研究论文,这是国际上首次报道有关线粒体内膜转位酶TIM22复合物的高分辨率冷冻电镜结构。
线粒体在细胞生命活动中执行包括能量代谢、细胞程序性死亡等重要作用。在线粒体进化过程中,其遗传系统经过重排,大多数线粒体的自身基因被转移至细胞核或者丢失。因此,线粒体中99%的蛋白需要在细胞质中核糖体上合成并精确地转运到特定线粒体亚结构区域才能发挥其功能。而线粒体蛋白转运由主要含有六种蛋白转运复合物的线粒体蛋白质转运系统负责,包括线粒体外膜转位酶(TOM)、线粒体内膜前导序列转位酶(TIM23)、线粒体内膜载体蛋白转位酶(TIM22)、线粒体外膜分选和装配机器(SAM)、线粒体转运复合物(MIM)和线粒体膜间隙转运与装配机器(MIA)。线粒体转运系统缺陷或功能紊乱,会导致多种复杂的人类疾病,例如癌症、神经退行性疾病和肌肉组织相关疾病。
载体蛋白是含有六次跨膜螺旋的膜蛋白的一类定位于线粒体内膜,它通过促进特定的底物扩散通过线粒体内膜或者利用膜电势转运代谢物质,来完成代谢物质转运进入或者转出线粒体基质。载体蛋白生物发生由TOM和TIM22复合物完成。TIM22复合物负责载体蛋白转运和插入到线粒体内膜。人源TIM22复合物包含至少6个组分:Tim22、Tim29、Tim9、Tim10a、Tim10b and AGK。尽管在TIM22复合物的功能和疾病发生研究中取得了很大进展,但是TIM22复合物的结构特征和载体蛋白的转运机制依然不清楚。
在该研究中,我校蛋白质科学研究团队成功将TIM22复合物6个亚基在哺乳动物细胞表达体系中共表达,通过冷冻电镜的方法进行数据收集和处理,解析了TIM22复合物的近原子分辨率结构。结果表明,在TIM22复合物结构中,含有1分子Tim22、Tim29、AGK蛋白;含有2个分子伴侣六聚体复合物Tim9/10a(3:3)和Tim9/10a/10b(2:3:1)。
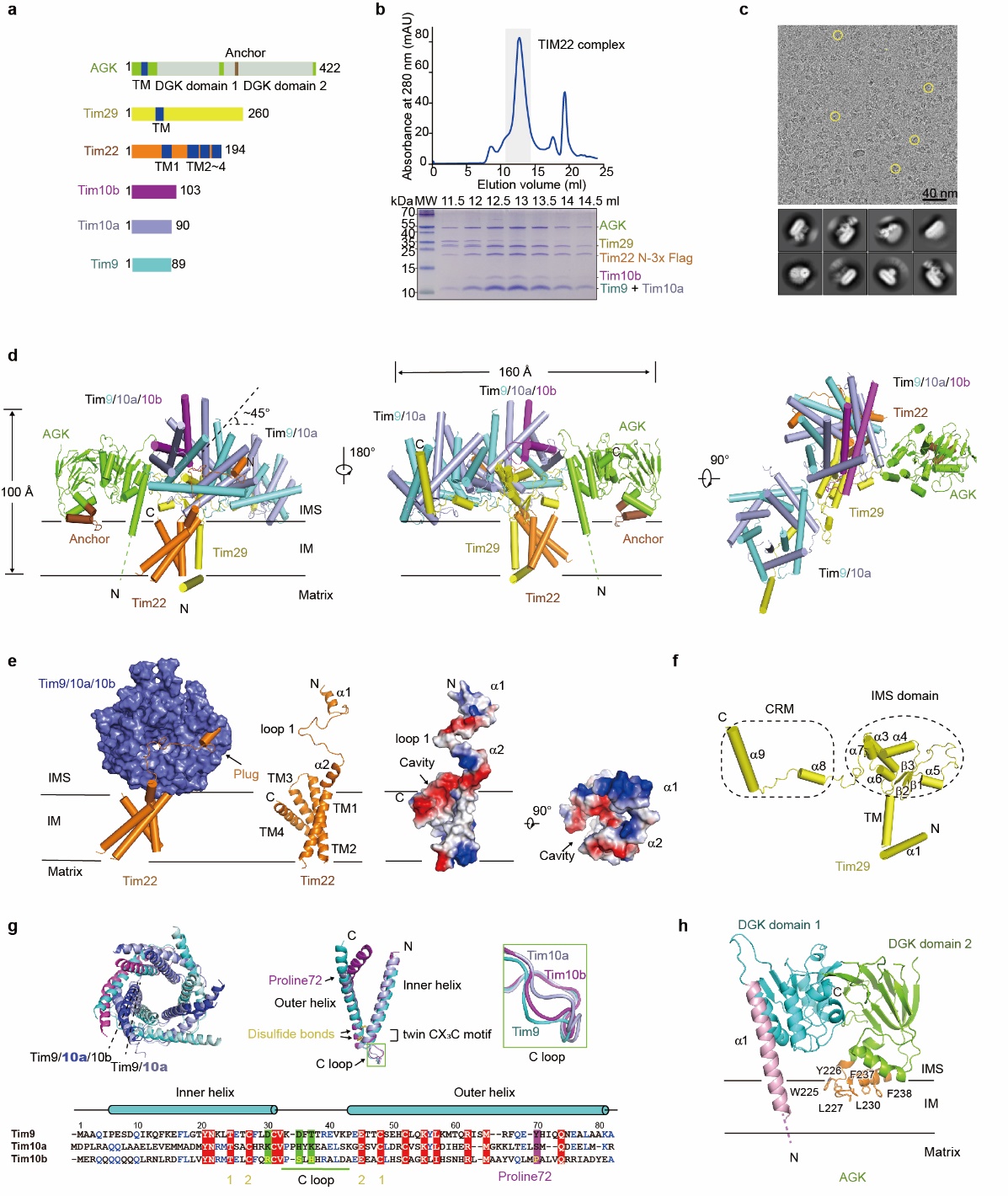
人源线粒体内膜转位酶TIM22复合物冷冻电镜结构示意图
Tim29是一个单次跨膜蛋白,通过其N端螺旋来稳定Tim22蛋白结构,同时通过其C端膜间隙结构域与AGK和2个分子伴侣六聚体复合物相互作用来维持TIM22复合物的完整性。Tim9/10a复合物接受通过线粒体外膜转位酶TOM复合物通道的载体蛋白前体,并传递给Tim9/10a/10b复合物,最后呈递给Tim22蛋白。Tim22蛋白包含4个跨膜螺旋,形成一个开口朝向脂双层的空腔,推测该空腔参与载体蛋白的插膜和横向分选到线粒体内膜过程。该研究揭示了TIM22复合物的自身装配和详细的结构信息,为进一步理解和研究载体蛋白通过TIM22复合物插入到线粒体内膜的分子机制提供结构基础,也为线粒体转运系统相关疾病提供潜在的药物靶点。
生科院博士生漆良波、王强和官泽源为该论文共同第一作者,殷平教授和闫创业研究员为共同通讯作者。前期冷冻样品制备和样品筛选主要在华中农业大学电镜平台完成,冷冻电镜数据收集在浙江大学冷冻电镜中心完成。该研究受到了科技部基金、国家自然科学基金、校自主创新基金的资助。
审核人:殷平
文章链接:http://www.nature.com/articles/s41422-020-00400-w


 旧版首页
旧版首页 全新首页
全新首页
 NCS
NCS  学术网站链接
学术网站链接  蛋白质化学工具
蛋白质化学工具  蛋白质平台
蛋白质平台  实用工具网站
实用工具网站 
 学术动态
学术动态  人文建设
人文建设  学术交流
学术交流  人物随感
人物随感  其他新闻
其他新闻  学术周边
学术周边  科学大事件
科学大事件 
 Online PDB
Online PDB  2024年
2024年  2023年
2023年  2022年
2022年  2021年
2021年  2020年
2020年  2019年
2019年  2018年
2018年  2017年
2017年  2016年
2016年  2015年
2015年  2014年
2014年  Prior to 2014
Prior to 2014 
 实验室概况
实验室概况  研究方向
研究方向 
 Thesis Defence
Thesis Defence  Lab Meeting
Lab Meeting  Fun Time
Fun Time  Awards
Awards  Talk
Talk  Notice
Notice  Experiment notebook
Experiment notebook  实验室安全教育
实验室安全教育 
 Groupleader
Groupleader  Associate Professor
Associate Professor  Postdoctoral Fellows
Postdoctoral Fellows  Ph.D Candidates
Ph.D Candidates  Master Candidates
Master Candidates  Undergraduate
Undergraduate  Collaborator
Collaborator  Former Lab Members
Former Lab Members 

 鄂公网安备 42011102000808号
鄂公网安备 42011102000808号 
