12月4日,作物遗传改良全国重点实验室、生命科学技术学院蛋白质科学研究团队在Cell Discovery杂志在线发表题为"The architecture of substrate-engaged TOM–TIM23 supercomplex reveals preprotein proximity sites for mitochondrial protein translocation"的研究论文。该研究成功解析了底物结合状态下TOM–TIM23超复合物的冷冻电镜结构,揭示了前体蛋白在进入线粒体过程中与外膜转位酶TOM复合物相互作用的关键位点,为线粒体蛋白质转运机制提供了新见解。
线粒体是真核细胞的能量工厂,含有1000多种蛋白质,其中约90%的线粒体蛋白在细胞质核糖体上合成后,通过特定的转运机制进入线粒体各区域。这些被称为前体蛋白的新生肽链通过线粒体外膜转位酶(TOM)和内膜转位酶(TIM23)组成的超复合物被转运至线粒体基质,但前体蛋白如何通过TOM复合物的具体机制尚不清楚。
在本研究中,研究团队通过在分离的酵母线粒体上捕获携带前导序列的Jac1sfGFP底物,成功稳定了TOM–TIM23–Jac1sfGFP超复合物。利用冷冻电镜技术,研究团队解析了该超复合物的整体结构,分辨率达到4.4Å。结构分析显示,TOM复合物和TIM23复合物分别位于两层非平行的去垢剂胶束中,两层胶束形成约35°的夹角。Tom22蛋白在连接这两个复合物中起关键作用。
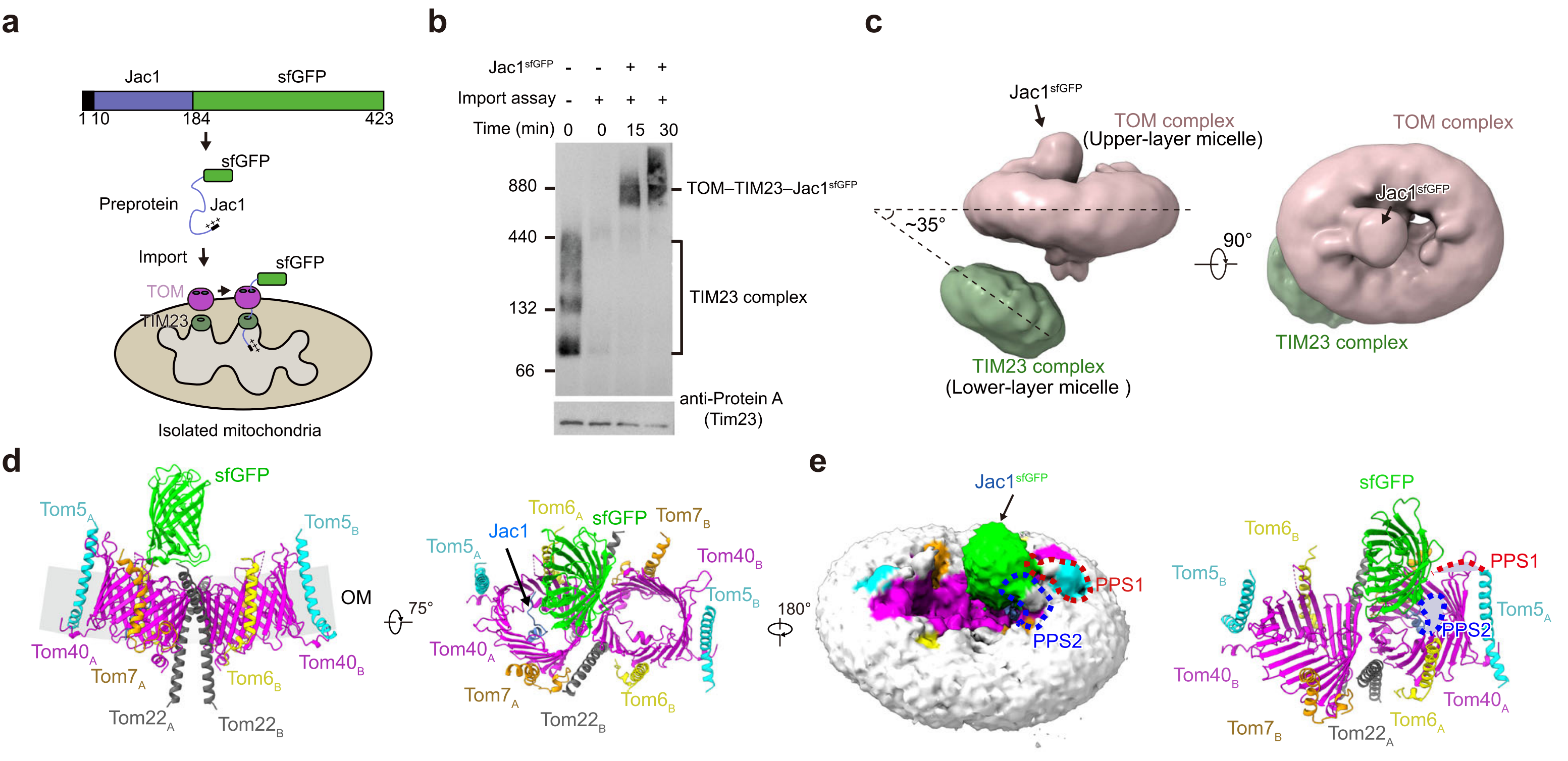
更重要的是,研究团队在TOM复合物的胞质侧发现了两个前体蛋白邻近位点(PPS):PPS1位于Tom5蛋白的N端(1-26位氨基酸),PPS2位于Tom40蛋白的β-链14和15之间的环区。功能研究表明,PPS1对前体蛋白的转运至关重要,删除Tom5蛋白2-20位氨基酸显著降低了前体蛋白的导入效率,且导致酵母在37°C条件下生长缺陷。交联质谱分析进一步证实了PPS1与前体蛋白的紧密接触。
通过结构比对,研究团队发现底物结合状态下Tom5蛋白向Tom40通道移动约3Å,表明Tom5可能对进入的底物产生响应。综合生化和结构数据,研究团队提出了前体蛋白跨膜转运的新模型:携带前导序列的前体蛋白首先被线粒体表面受体识别,随后在PPS1的引导下被递送至Tom40通道,最终通过TIM23复合物转运至线粒体基质。
综上,本研究揭示了前体蛋白如何通过线粒体外膜的分子机制,发现PPS1在前体蛋白转运的后受体阶段发挥关键作用。这些发现为理解线粒体蛋白质转运的全过程奠定了基础,也为线粒体相关疾病的机制研究提供了新思路。


 旧版首页
旧版首页 全新首页
全新首页
 NCS
NCS  学术网站链接
学术网站链接  蛋白质化学工具
蛋白质化学工具  蛋白质平台
蛋白质平台  实用工具网站
实用工具网站 
 学术动态
学术动态  人文建设
人文建设  学术交流
学术交流  人物随感
人物随感  其他新闻
其他新闻  学术周边
学术周边  科学大事件
科学大事件 
 Online PDB
Online PDB  2024年
2024年  2023年
2023年  2022年
2022年  2021年
2021年  2020年
2020年  2019年
2019年  2018年
2018年  2017年
2017年  2016年
2016年  2015年
2015年  2014年
2014年  Prior to 2014
Prior to 2014 
 实验室概况
实验室概况  研究方向
研究方向 
 Thesis Defence
Thesis Defence  Lab Meeting
Lab Meeting  Fun Time
Fun Time  Awards
Awards  Talk
Talk  Notice
Notice  Experiment notebook
Experiment notebook  实验室安全教育
实验室安全教育 
 Groupleader
Groupleader  Associate Professor
Associate Professor  Postdoctoral Fellows
Postdoctoral Fellows  Ph.D Candidates
Ph.D Candidates  Master Candidates
Master Candidates  Undergraduate
Undergraduate  Collaborator
Collaborator  Former Lab Members
Former Lab Members 

 鄂公网安备 42011102000808号
鄂公网安备 42011102000808号 
