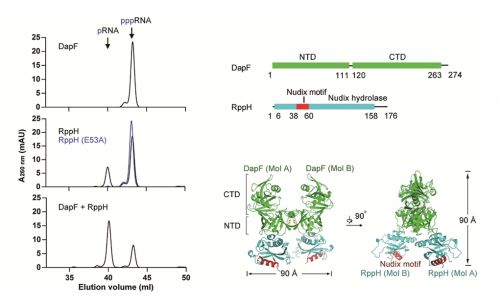
南湖网讯(通讯员 裴凯)2018 年6月21日,国际知名学术期刊《Nucleic Acids Research》在线发表了我校生科院/作物遗传改良国家重点实验室殷平教授团队关于DapF-RppH复合物结构和功能的最新研究进展,论文以“DapF stabilizes the substrate-favoring conformation of RppH tostimulate its RNA-pyrophosphohydrolase activity in Escherichia coli” 为题,报道了第一个RNA的5′端三磷酸基团水解复合物的结构,并阐明了DapF蛋白调节RppH活性的分子机制。
mRNA的迅速降解是细胞适应环境的一种生存策略,其5′端状态是mRNA被降解速率的决定因素之一。mRNA的5′端常携有一类“帽子”结构,如m7G及其衍生物、NAD和三磷酸基团,它们能帮助mRNA抵抗来自各种核酸内切酶和外切酶的降解;只有当这些“帽子”结构被特定的水解酶去除以后,mRNA才能被核酸酶进一步降解。细胞体内有一系列的“去帽”酶,如Dcp2、NudC和RppH等,负责"帽子”结构的水解。这一类“去帽”酶的活性受调节,它们能与各种辅因子形成“去帽”复合物,加速对“帽子”结构的水解速率,研究这些“去帽”酶与其底物、其调控因子复合物的结构和功能可加深我们对胞内RNA降解调控的理解。
RppH是一种焦磷酸水解酶,在细菌当中广泛存在,它能水解mRNA的5′端三磷酸基团,其活性受到辅因子DapF蛋白的直接调控。在DapF蛋白存在下,RppH能加速目标mRNA的降解,但是其分子机制不清楚。在殷平教授课题组的这项研究当中,他们解析了DapF和RppH蛋白复合物的高分辨率晶体结构(2.3 Å),并且通过一系列生化分析和结构比对,发现DapF与RppH结合后,促进了后者发生轻微的构象变化,从而增强了RppH与底物RNA的结合。这些实验结果清晰的解释了DapF蛋白促进RppH活性的分子机制,为进一步寻找细菌中“去帽”复合物的新成员奠定了良好的基础。该研究不仅回答了细菌体内mRNA降解的几个关键科学问题,并且为针对致病菌的药物开发能提供新的潜在作用靶点。
据悉,此篇文章是殷平教授课题组关于RNA代谢调控研究的系列工作之一,2016年8月,其课题组关于RNA的5′端NAD修饰降解的工作就以题为“Structuralbasis of prokaryotic NAD-RNA decapping by NudC”的论文发表在《Cell Research》杂志上,这两个相关的工作利用结构生物学和生物化学的方法,阐述了关于RNA的5′端保护结构是如何被水解以及如何被调控,从而影响RNA的代谢。
我校生科院博士生王强和副研究员张德林为该论文共同第一作者,殷平教授为通讯作者。该研究工作获得了华中农业大学自主科技创新基金和人才启动基金的经费资助,我校蛋白质平台为该研究提供了强有力的支持,上海同步辐射光源BL17U1和国家蛋白质科学中心BL19U1线站为晶体衍射数据收集提供了必要保障。
文章链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gky528/5042035
https://www.nature.com/articles/cr201698
审核人:殷平


 旧版首页
旧版首页 全新首页
全新首页
 NCS
NCS  学术网站链接
学术网站链接  蛋白质化学工具
蛋白质化学工具  蛋白质平台
蛋白质平台  实用工具网站
实用工具网站 
 学术动态
学术动态  人文建设
人文建设  学术交流
学术交流  人物随感
人物随感  其他新闻
其他新闻  学术周边
学术周边  科学大事件
科学大事件 
 Online PDB
Online PDB  2024年
2024年  2023年
2023年  2022年
2022年  2021年
2021年  2020年
2020年  2019年
2019年  2018年
2018年  2017年
2017年  2016年
2016年  2015年
2015年  2014年
2014年  Prior to 2014
Prior to 2014 
 实验室概况
实验室概况  研究方向
研究方向 
 Thesis Defence
Thesis Defence  Lab Meeting
Lab Meeting  Fun Time
Fun Time  Awards
Awards  Talk
Talk  Notice
Notice  Experiment notebook
Experiment notebook  实验室安全教育
实验室安全教育 
 Groupleader
Groupleader  Associate Professor
Associate Professor  Postdoctoral Fellows
Postdoctoral Fellows  Ph.D Candidates
Ph.D Candidates  Master Candidates
Master Candidates  Undergraduate
Undergraduate  Collaborator
Collaborator  Former Lab Members
Former Lab Members 

 鄂公网安备 42011102000808号
鄂公网安备 42011102000808号 
