核心提示: 2018 年9月18日,国际知名学术期刊《Nature Microbiology》在线发表了我校蛋白质科学研究团队邹婷婷副教授关于AimR结合底物多肽复合物结构和功能的最新研究进展,论文阐述了噬菌体溶原裂解途径决定的新机制。
南湖网讯(通讯员 裴凯)2018 年9月18日,国际知名学术期刊《Nature Microbiology》在线发表了我校蛋白质科学研究团队关于AimR结合底物多肽复合物结构和功能的最新研究进展,论文以“Structural basis of the arbitrium peptide–AimR communication system in thephage lysis–lysogeny decision”为题,阐述了决定噬菌体溶原裂解途径的一类新型分子调控机制。
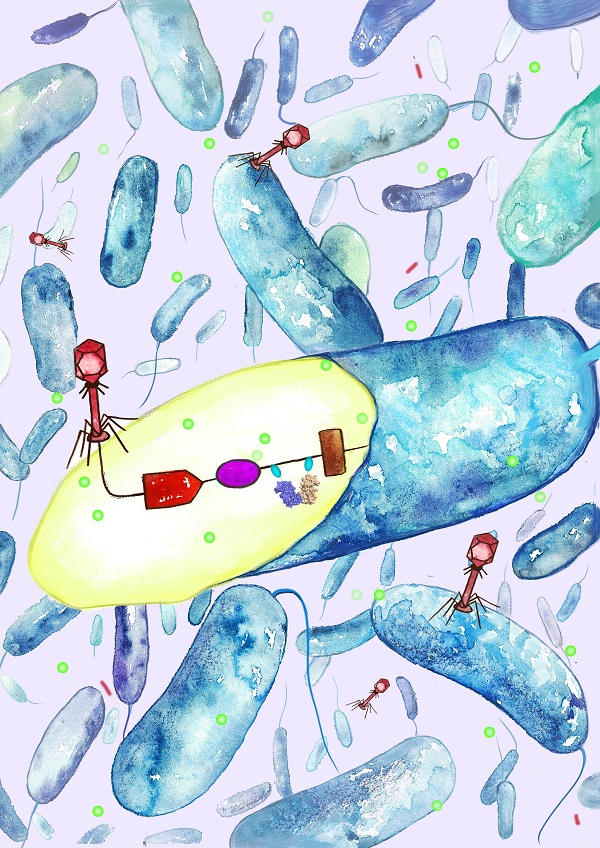
温和噬菌体在侵染细菌后,可以根据环境不同选择进入裂解途径或者溶原途径。最经典的例子是λ噬菌体侵染大肠杆菌,λ噬菌体基因组上的pL和pR启动子决定着其溶原或者裂解的命运。近年来,科学家在枯草芽孢杆菌中发现了一类新的决定机制:AimR-AimP-AimX决定系统。AimP编码43个氨基酸的多肽,分泌至细胞外被切割成6个氨基酸的成熟短肽(arbitriumpeptide);AimR是信号短肽的受体,同时作为转录调控因子调控aimX基因的表达;AimX是噬菌体溶原途径的负调控因子。信号短肽运至细胞内与AimR结合,解除AimR对aimX基因的调控作用,使噬菌体进入溶原周期。这类决定系统广泛存在于不同类噬菌体中。然而,噬菌体如何识别信号短肽,信号短肽又如何解除AimR与DNA结合的分子机制并不清楚。
本研究利用细胞生物学、结构生物学、生物化学和生物物理等多重手段揭示了来源于SPbeta类噬菌体信号短肽的作用分子机制,并通过解析了AimR的晶体结构以及信号短肽结合状态下AimR复合物的高分辨率晶体结构,发现AimR呈现超螺旋结构,结构显示AimR属于RRNPP 蛋白家族(革兰氏阳性菌群体感应系统的关键蛋白),短肽结合在AimR的螺旋空腔里面。通过结构比对,AimR未结合和结合短肽分子均为二聚体,仅有一个轻微的变化,不足以脱离DNA。研究者们发现AimR的N端是结合 DNA的关键部位,但未能捕捉其构象。我校新引进的刘主教授擅长蛋白动态结构分析,团队人员密切合作,通过小角散射等一系列生化和生物物理实验验证了短肽结合下AimR 的N端更加舒张,从而可能使整个AimR脱离靶标DNA。该研究解释了SPbeta噬菌体溶原裂解途径中短肽识别的关键问题,为进一步研究噬菌体对溶原和裂解途径的选择提供重要线索。
我校生科院研究生王强和官泽源为该论文共同第一作者,邹婷婷副教授为通讯作者。该研究是和农业微生物国家重点实验室彭东海副教授合作,体现了院室相互融合。同时蛋白质研究团队成员充分合作,研究手段互补。该研究工作获得了华中农业大学自主科技创新基金和国家自然科学基金青年基金项目资助,我校蛋白质平台为该研究提供了强有力的支持,上海同步辐射光源BL17U1、国家蛋白质科学中心BL19U1和BL19U2线站为晶体衍射和小角散射数据收集提供了必要保障。
审核人:邹婷婷
文章链接:https://www.nature.com/articles/s41564-018-0239-y


 旧版首页
旧版首页 全新首页
全新首页
 NCS
NCS  学术网站链接
学术网站链接  蛋白质化学工具
蛋白质化学工具  蛋白质平台
蛋白质平台  实用工具网站
实用工具网站 
 学术动态
学术动态  人文建设
人文建设  学术交流
学术交流  人物随感
人物随感  其他新闻
其他新闻  学术周边
学术周边  科学大事件
科学大事件 
 Online PDB
Online PDB  2024年
2024年  2023年
2023年  2022年
2022年  2021年
2021年  2020年
2020年  2019年
2019年  2018年
2018年  2017年
2017年  2016年
2016年  2015年
2015年  2014年
2014年  Prior to 2014
Prior to 2014 
 实验室概况
实验室概况  研究方向
研究方向 
 Thesis Defence
Thesis Defence  Lab Meeting
Lab Meeting  Fun Time
Fun Time  Awards
Awards  Talk
Talk  Notice
Notice  Experiment notebook
Experiment notebook  实验室安全教育
实验室安全教育 
 Groupleader
Groupleader  Associate Professor
Associate Professor  Postdoctoral Fellows
Postdoctoral Fellows  Ph.D Candidates
Ph.D Candidates  Master Candidates
Master Candidates  Undergraduate
Undergraduate  Collaborator
Collaborator  Former Lab Members
Former Lab Members 

 鄂公网安备 42011102000808号
鄂公网安备 42011102000808号 
