南湖新闻网讯(通讯员 左佳琦)近日,湖北洪山实验室、作物遗传改良国家重点实验室、生命科学技术学院的蛋白质科学研究团队蛋白质动态学课题组在Nature Communications杂志在线发表题为“Mechanistic insights into the regulation of plant phosphate homeostasis by the rice SPX2 – PHR2 complex”的研究论文,揭示了水稻SPX2– PHR2复合物感知磷信号、调控磷稳态的分子机制。
磷是影响生命体生长发育、决定作物产量的重要营养元素。农业生产上,为了增产,磷肥的过度使用引发了系列环境问题。研究作物的磷稳态维持机制,具有重要的理论与实践意义。已有研究表明:低磷条件下,水稻磷稳态调控的核心转录因子–PHR2通过二聚化结合顺式调控元件(P1BS),激活一系列磷饥饿响应基因的表达,促进磷的吸收与利用;高磷条件下,SPX2蛋白感知磷信号,进而结合并抑制PHR2的转录活性,维持磷稳态,避免磷中毒。但SPX2如何感知和传递磷信号的具体分子机制,尚不清楚。
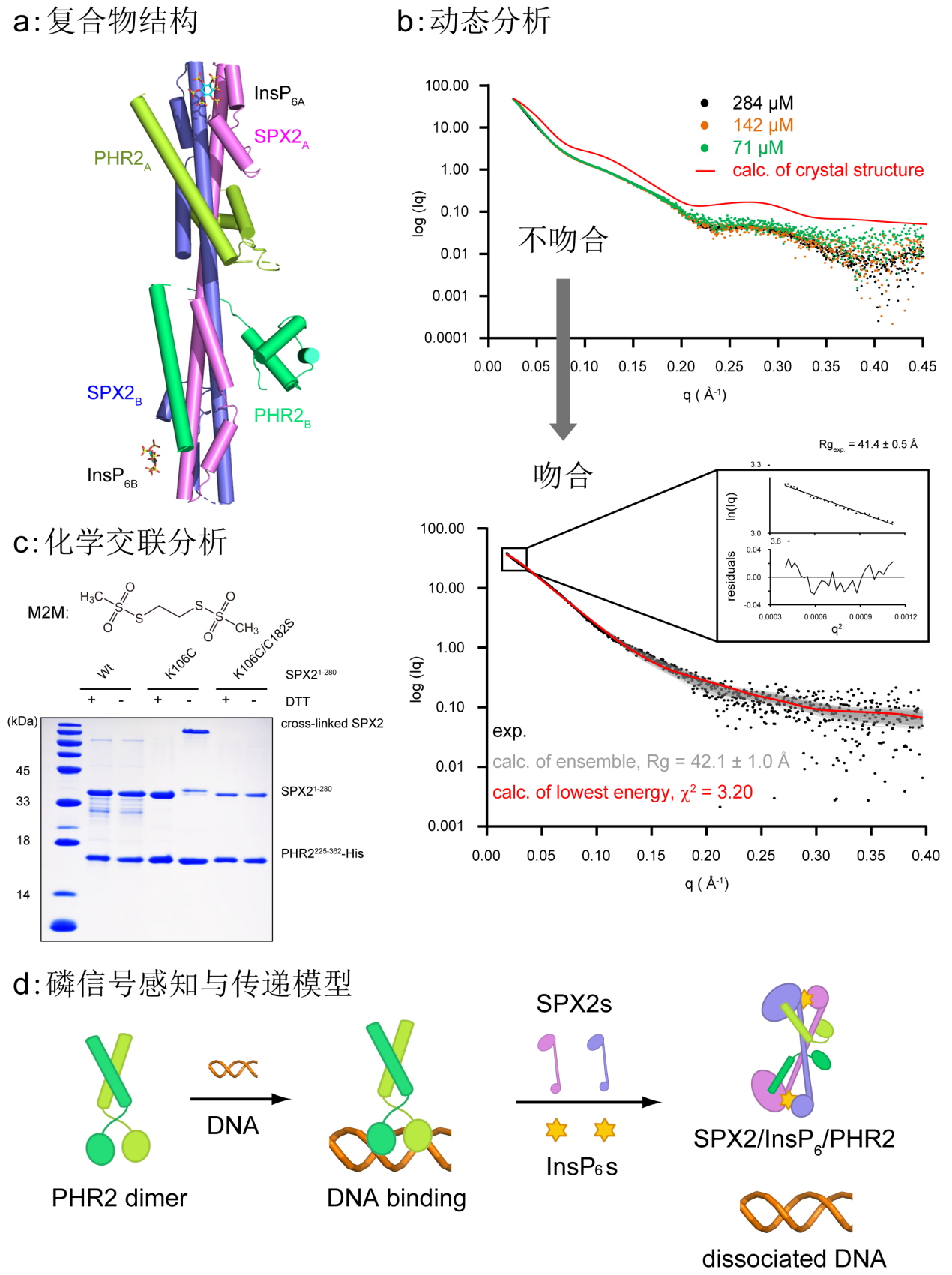
图1. 多技术联用,结合复合物结构、动态分析、化学交联分析,阐明SPX2受体感知和传递磷信号,进而抑制PHR2转录活性的分子机制。
动态学题组采用整合结构生物学策略,联用多种生物物理技术手段,综合结构基础与动态分析,揭示了SPX2受体感受磷信号分子–磷酸肌醇(InsP6)、传递磷信号进而调控水稻磷稳态的分子机制(图1): SPX2通过寡聚状态的动态变化,以独特的结构域交互构象感知InsP6信号,并以dimer of dimer的方式结合PHR2;这种独特的结合方式,空间排斥了PHR2结合PIBS,并打破了PHR2的二聚化,进而抑制PHR2的转录活性,维持磷稳态。该研究从机制上阐明了水稻磷动态平衡的分子基础,对水稻农艺性状的遗传改良和合理施肥具有指导意义,为因地制宜的选育不同磷酸盐吸收能力的水稻品种提供了重要参考。
生科院官泽源博士、张群霞博士和张治飞同学为该论文共同第一作者,刘主教授为该论文通讯作者。校级蛋白质平台为该研究提供了强有力的支持,样品的衍射和散射数据在上海同步辐射光源收集。该研究受到了科技部、国家自然科学基金委、校自主创新基金的资助。官泽源博士特别感谢博士后创新人才计划、博士后面上基金、生科院博士后百川计划的支持。
【英文摘要】
Phosphate (Pi) starvation response (PHR) transcription factors play key roles in plant Pi homeostasis maintenance. They are negatively regulated by stand-alone SPX proteins, cellular receptors for inositol pyrophosphate (PP-InsP) nutrient messengers. How PP-InsP-bound SPX interacts with PHRs is poorly understood. Here, we report crystal structures of the rice SPX2/InsP6/PHR2 complex and of the PHR2 DNA binding (MYB) domain in complex with target DNA at resolutions of 3.1 Å and 2.7 Å, respectively. In the SPX2/InsP6/PHR2 complex, the signalling-active SPX2 assembles into a domain-swapped dimer conformation and binds two copies of PHR2, targeting both its coiled-coil (CC) oligomerisation domain and MYB domain. Our results reveal that the SPX2 senses PP-InsPs to inactivate PHR2 by establishing severe steric clashes with the PHR2 MYB domain, preventing DNA binding, and by disrupting oligomerisation of the PHR2 CC domain, attenuating promoter binding. Our findings rationalize how PP-InsPs activate SPX receptor proteins to target PHR family transcription factors.
论文链接:https://www.nature.com/articles/s41467-022-29275-8
审核:殷平


 旧版首页
旧版首页 全新首页
全新首页
 NCS
NCS  学术网站链接
学术网站链接  蛋白质化学工具
蛋白质化学工具  蛋白质平台
蛋白质平台  实用工具网站
实用工具网站 
 学术动态
学术动态  人文建设
人文建设  学术交流
学术交流  人物随感
人物随感  其他新闻
其他新闻  学术周边
学术周边  科学大事件
科学大事件 
 Online PDB
Online PDB  2024年
2024年  2023年
2023年  2022年
2022年  2021年
2021年  2020年
2020年  2019年
2019年  2018年
2018年  2017年
2017年  2016年
2016年  2015年
2015年  2014年
2014年  Prior to 2014
Prior to 2014 
 实验室概况
实验室概况  研究方向
研究方向 
 Thesis Defence
Thesis Defence  Lab Meeting
Lab Meeting  Fun Time
Fun Time  Awards
Awards  Talk
Talk  Notice
Notice  Experiment notebook
Experiment notebook  实验室安全教育
实验室安全教育 
 Groupleader
Groupleader  Associate Professor
Associate Professor  Postdoctoral Fellows
Postdoctoral Fellows  Ph.D Candidates
Ph.D Candidates  Master Candidates
Master Candidates  Undergraduate
Undergraduate  Collaborator
Collaborator  Former Lab Members
Former Lab Members 

 鄂公网安备 42011102000808号
鄂公网安备 42011102000808号 
