南湖新闻网讯(通讯员 王意东 )2022年4月20日,Science Advances在线发表了我校湖北洪山实验室和作物遗传改良国家重点实验室蛋白质科学研究团队联合北京大学邓兴旺教授课题组的研究论文“Structural insight into UV-B–activated UVR8 bound to COP1”。该研究揭示了植物紫外光UV-B受体UVR8结合光形态建成核心抑制因子COP1-SPAs复合物并与该复合物的底物蛋白HY5竞争性结合COP1-SPAs的分子机制。
光是植物生长发育必不可少的环境因子。植物通过不同的光受体来感知光从而启动光形态建成。COP1-SPAs复合物是植物光形态建成中的核心抑制因子,该复合物在植物体内发挥E3泛素连接酶的功能,参与一系列光形态建成核心调控因子的降解。光激活的光受体(例如紫外光UV-B受体UVR8,蓝光受体CRYs)能够负调控COP1-SPAs复合物的E3泛素连接酶活性,抑制COP1-SPAs复合物底物的降解,从而使植物体启动光形态建成。不同光受体介导的信号通路如何调节COP1-SPAs活性的分子机制未知,其中最大研究困难在于COP1-SPAs复合物蛋白难于被表达纯化及表征活性。
在该研究中,研究者经过长时间的探索,最终成功在异源体系中表达纯化出均一稳定的COP1-SPA4复合体蛋白,这为后续工作开展奠定了基础。研究者在体外重构了UVR8-COP1-SPA4介导的UV-B 信号通路。结果表明,UV-B 可以使处于二聚体基态的UVR8激活为单体。光激活的单体UVR8可以在体外与COP1-SPA4复合物的底物HY5竞争结合该复合物,形成新的稳定复合物UVR8-COP1-SPA4。而UV-B信号通路的负调控因子RUP2则可以将UVR8从UVR8-COP1-SPA4复合体上解离下来,促进UVR8的重新二聚化从而失去活性。
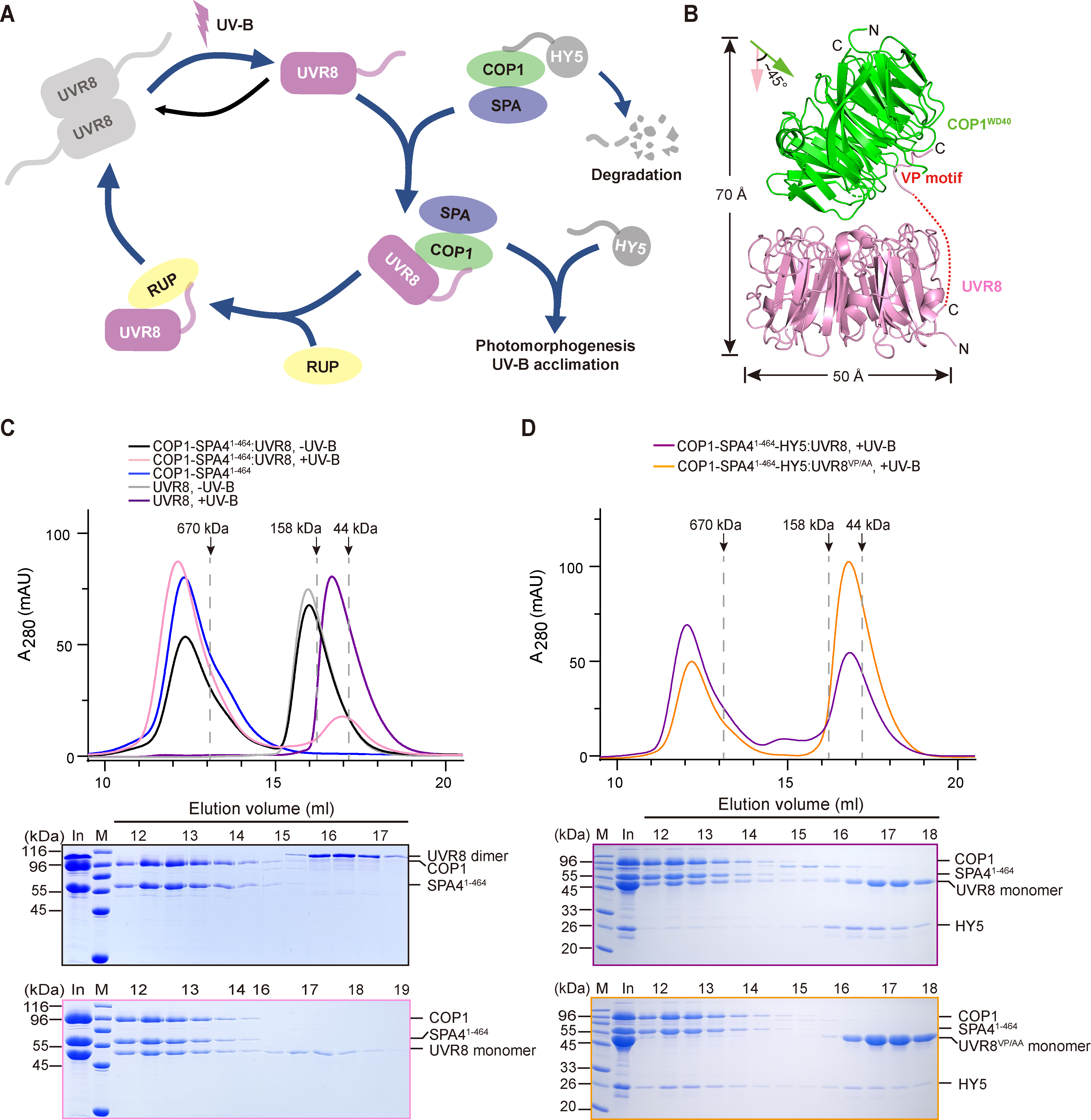
图一.光激活UVR8-COP1-SPA4复合体介导的紫外光UV-B信号转导通路
随后,研究者解析了光激活态UVR8-COP1复合体的冷冻电镜结构,分辨率为3.1Å。该结构表明光激活的UVR8与COP1的WD40结构域形成两个互作界面,生化实验证明这两个互作界面是UVR8和COP1发生互作以及竞争COP-SPA底物HY5所必需的。该结构也首次揭示了光激活态的UVR8核心结构域的结构特征,并与之前报道的其他野生型或者突变型UVR8核心结构域比对,鉴定到UVR8的激活态突变体UVR8W285A,D96N,D107N和UVR8W285A,G01S。此外,作者推测RUP2可能也以类似于UVR8-COP1互作的方式与UVR8发生相互作用,从而使激活态的UVR8从COP1-SPA4-UVR8复合体上解离。
该研究阐明了光激活UVR8和COP1发生相互作用以及与COP1-SPA底物HY5竞争性结合COP1-SPA的分子机制,不仅为理解植物光信号转导调控奠定了基础,也为光遗传学工具蛋白的开发提供了理论依据,更有望为培育优良农林作物品种提供科学指导。
王意东、王丽霞和官泽源为本论文共同第一作者,我校殷平教授和北京大学邓兴旺教授为共同通讯作者。南方科技大学李健副研究员也参与该研究。我校校级蛋白质平台为该研究的开展提供了支持。前期冷冻样品制备和样品筛选主要在华中农业大学电镜平台完成,冷冻电镜数据收集在南方科技大学冷冻电镜中心完成。该研究受到了科技部基金、国家自然科学基金、洪山实验室基金、武汉市应用基础前沿项目基金以及南方科技大学校长基金的资助。
【英文摘要】
The CONSTITUTIVE PHOTOMORPHOGENIC 1-SUPPRESSOR OF PHYA-105 (COP1-SPA) complex is a central repressor of photomorphogenesis. This complex acts as an E3 ubiquitin ligase downstream of various light signaling transduced from multiple photoreceptors in plants. How the COP1-SPA activity is regulated by divergent light-signaling pathways remains largely elusive. Here, we reproduced the regulation pathway of COP1-SPA in ultraviolet-B (UV-B) signaling in vitro and determined the cryo-electron microscopy structure of UV-B receptor UVR8 in complex with COP1. The complex formation is mediated by two-interface interactions between UV-B-activated UVR8 and COP1. Both interfaces are essential for the competitive binding of UVR8 against the signaling hub component HY5 to the COP1-SPA complex. We also show that RUP2 dissociates UVR8 from the COP1-SPA41–464-UVR8 complex and facilitates its redimerization. Our results support a UV-B signaling model that the COP1-SPA activity is repressed by UV-B-activated UVR8 and derepressed by RUP2, owing to competitive binding, and provide a framework for studying the regulatory roles of distinct photoreceptors on photomorphogenesis.
文章链接: https://www.science.org/doi/10.1126/sciadv.abn3337
https://www.science.org/doi/10.1126/sciadv.abn3337
审核人:殷平


 旧版首页
旧版首页 全新首页
全新首页
 NCS
NCS  学术网站链接
学术网站链接  蛋白质化学工具
蛋白质化学工具  蛋白质平台
蛋白质平台  实用工具网站
实用工具网站 
 学术动态
学术动态  人文建设
人文建设  学术交流
学术交流  人物随感
人物随感  其他新闻
其他新闻  学术周边
学术周边  科学大事件
科学大事件 
 Online PDB
Online PDB  2024年
2024年  2023年
2023年  2022年
2022年  2021年
2021年  2020年
2020年  2019年
2019年  2018年
2018年  2017年
2017年  2016年
2016年  2015年
2015年  2014年
2014年  Prior to 2014
Prior to 2014 
 实验室概况
实验室概况  研究方向
研究方向 
 Thesis Defence
Thesis Defence  Lab Meeting
Lab Meeting  Fun Time
Fun Time  Awards
Awards  Talk
Talk  Notice
Notice  Experiment notebook
Experiment notebook  实验室安全教育
实验室安全教育 
 Groupleader
Groupleader  Associate Professor
Associate Professor  Postdoctoral Fellows
Postdoctoral Fellows  Ph.D Candidates
Ph.D Candidates  Master Candidates
Master Candidates  Undergraduate
Undergraduate  Collaborator
Collaborator  Former Lab Members
Former Lab Members 

 鄂公网安备 42011102000808号
鄂公网安备 42011102000808号 
